- লেখক Jason Gerald [email protected].
- Public 2024-02-01 14:11.
- সর্বশেষ পরিবর্তিত 2025-01-23 12:08.
আপনি কি কখনও কয়েক ঘন্টার জন্য প্রখর রোদে পানির বোতল রেখেছেন এবং যখন আপনি এটি খুলেন তখন সামান্য "হিসিং" শব্দ শুনেছেন? এটি বাষ্প চাপ নামে একটি নীতির কারণে। রসায়নে, বাষ্পের চাপ হল একটি বন্ধ পাত্রে দেয়াল দ্বারা চাপানো চাপ যখন রাসায়নিক পদার্থ বাষ্প হয়ে যায় (গ্যাসে পরিণত হয়)। প্রদত্ত তাপমাত্রায় বাষ্পের চাপ খুঁজে পেতে, ক্লোসিয়াস-ক্ল্যাপায়রন সমীকরণটি ব্যবহার করুন: ln (P1/P2) = (ΔHবাষ্প/আর) ((1/টি 2) - (1/টি 1)).
ধাপ
3 এর মধ্যে 1 পদ্ধতি: ক্লাউসিয়াস-ক্ল্যাপায়রন সমীকরণ ব্যবহার করা
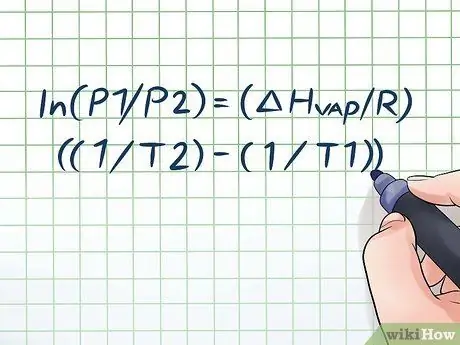
ধাপ 1. Clausius-Clapeyron সমীকরণটি লিখ।
সময়ের সাথে বাষ্পের চাপের পরিবর্তনের সাথে বাষ্পের চাপ গণনা করার জন্য যে সূত্রটি ব্যবহার করা হয় তাকে বলা হয় ক্লোসিয়াস -ক্ল্যাপায়রন সমীকরণ (পদার্থবিজ্ঞানী রুডলফ ক্লাউসিয়াস এবং বেনোত পল মাইল ক্লেপাইরনের নামে।) এটি মূলত সেই সূত্র যা আপনাকে অধিকাংশ ধরনের সমস্যার সমাধান করতে হবে বাষ্প চাপের প্রশ্ন প্রায়ই পদার্থবিজ্ঞান এবং রসায়ন ক্লাসে পাওয়া যায়। সূত্রটি এরকম: ln (P1/P2) = (ΔHবাষ্প/আর) ((1/টি 2) - (1/টি 1)) । এই সূত্রে, ভেরিয়েবলগুলি প্রতিনিধিত্ব করে:
-
জবাষ্প:
তরলের বাষ্পীকরণের এনথ্যালপি। এই এনথ্যালপি সাধারণত রসায়ন পাঠ্যপুস্তকের পিছনে টেবিলে পাওয়া যায়।
-
আর:
বাস্তব/সার্বজনীন গ্যাস ধ্রুবক, বা 8.314 জে/(কে -মোল)।
-
প্রশ্ন 1:
যে তাপমাত্রায় বাষ্পের চাপ জানা যায় (বা প্রাথমিক তাপমাত্রা)।
-
T2:
যে তাপমাত্রায় বাষ্পের চাপ অজানা/খুঁজে পেতে চেয়েছিল (বা চূড়ান্ত তাপমাত্রা)।
-
P1 এবং P2:
তাপমাত্রায় বাষ্পের চাপ যথাক্রমে T1 এবং T2।

ধাপ 2. আপনি যে ভেরিয়েবলগুলি জানেন তা লিখুন।
Clausius-Clapeyron সমীকরণটি জটিল বলে মনে হচ্ছে কারণ এর অনেকগুলি ভিন্ন ভেরিয়েবল রয়েছে, কিন্তু আপনার কাছে সঠিক তথ্য থাকলে এটি আসলে তেমন কঠিন নয়। বেশিরভাগ মৌলিক বাষ্প চাপের সমস্যাগুলি তাপমাত্রার দুটি মান এবং চাপের একটি মান বা চাপের দুটি মান এবং তাপমাত্রার একটি মান তালিকাভুক্ত করবে - একবার আপনি বুঝতে পারলে এই সমীকরণটি সমাধান করা খুব সহজ।
- উদাহরণস্বরূপ, বলুন যে আমাদের বলা হয়েছে যে আমাদের 295 K তে তরল ভরা একটি পাত্রে আছে যার বাষ্পের চাপ 1 বায়ুমণ্ডল (এটিএম)। আমাদের প্রশ্ন হল: 393 K তে বাষ্পের চাপ কত? আমাদের দুটি তাপমাত্রার মান এবং একটি চাপের মান আছে, তাই আমরা ক্লাউসিয়াস-ক্ল্যাপায়রন সমীকরণ ব্যবহার করে অন্যান্য চাপের মান খুঁজে পেতে পারি। আমাদের ভেরিয়েবল প্লাগ ইন করে, আমরা পাই ln (1/P2) = (ΔHবাষ্প/আর) ((1/393) - (1/295)).
- উল্লেখ্য, ক্লোসিয়াস-ক্ল্যাপায়রন সমীকরণের জন্য, আপনাকে সর্বদা তাপমাত্রার মান ব্যবহার করতে হবে কেলভিন । আপনি যতক্ষণ P1 এবং P2 এর মান একই থাকবে ততক্ষণ আপনি যেকোনো চাপ মান ব্যবহার করতে পারেন।

ধাপ 3. আপনার ধ্রুবক লিখুন।
Clausius-Clapeyron সমীকরণের দুটি ধ্রুবক রয়েছে: R এবং Hবাষ্প। R সর্বদা 8.314 J/(K -Mol) এর সমান। যাইহোক, এইচবাষ্প (বাষ্পীকরণের এনথালপি) সেই পদার্থের উপর নির্ভর করে যার বাষ্পের চাপ আপনি খুঁজছেন। উপরে উল্লিখিত হিসাবে, আপনি সাধারণত H এর মানগুলি খুঁজে পেতে পারেনবাষ্প একটি রসায়ন বা পদার্থবিজ্ঞান পাঠ্যপুস্তকের পিছনে বিভিন্ন পদার্থের জন্য, অথবা অনলাইন (যেমন, উদাহরণস্বরূপ, এখানে।)
-
আমাদের উদাহরণে, ধরুন আমাদের তরল বিশুদ্ধ পানি.
যদি আমরা টেবিলে H এর মান দেখিবাষ্প, আমরা খুঁজে পাই যে এইচবাষ্প বিশুদ্ধ পানি প্রায় 40.65 KJ/mol যেহেতু আমাদের H মান জোলসে, এবং কিলোজুল নয়, আমরা এটিকে রূপান্তর করতে পারি 40,650 জে/মোল
- আমাদের ধ্রুবকগুলির মধ্যে প্লাগিং, আমরা পাই ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295)).
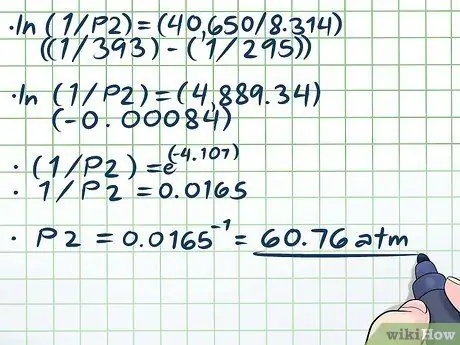
ধাপ 4. সমীকরণটি সমাধান করুন।
একবার আপনি সমীকরণে সমস্ত ভেরিয়েবল অন্তর্ভুক্ত করেছেন যা আপনি খুঁজছেন তা ছাড়া, সাধারণ বীজগণিতের নিয়ম অনুযায়ী সমীকরণটি সমাধান করতে এগিয়ে যান।
-
আমাদের সমীকরণ সমাধানের একমাত্র কঠিন অংশ (ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))) প্রাকৃতিক লগ (ln) সমাধান করছে। প্রাকৃতিক লগ অপসারণের জন্য, শুধু গাণিতিক ধ্রুবক ই এর জন্য সমীকরণের উভয় পক্ষকেই সূচক হিসেবে ব্যবহার করুন। অন্য কথায়, ln (x) = 2 → eln (x) = ই2 → x = ই2.
- এখন, আমাদের সমীকরণ সমাধান করা যাক:
- ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = ই(-4, 107)
- 1/পি 2 = 0.0165
-
P2 = 0.0165-1 = 60, 76 এটিএম
এটি বোধগম্য - একটি বদ্ধ পাত্রে, তাপমাত্রা প্রায় 100 ডিগ্রী (স্ফুটনাঙ্ক থেকে প্রায় 20 ডিগ্রি উপরে) অনেক বাষ্প তৈরি করবে, দ্রুত চাপ বাড়াবে।
3 এর 2 পদ্ধতি: দ্রবীভূত দ্রবণ দিয়ে বাষ্পের চাপ খুঁজে বের করা
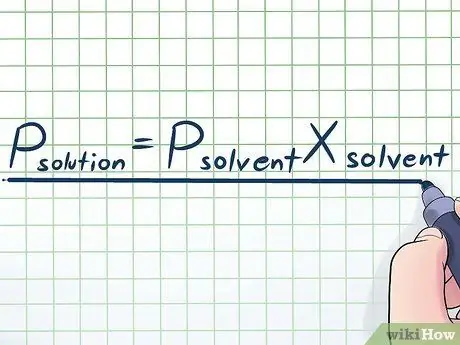
ধাপ 1. রাউল্ট এর আইন লিখুন।
বাস্তব জীবনে, আমরা খুব কমই বিশুদ্ধ তরল দিয়ে কাজ করি - সাধারণত, আমরা এমন তরল দিয়ে কাজ করি যা বিভিন্ন পদার্থের মিশ্রণ। সর্বাধিক ব্যবহৃত কিছু মিশ্রণ দ্রবণ তৈরির জন্য দ্রাবক নামক অনেক রাসায়নিক দ্রব্যে দ্রবণ নামক একটি নির্দিষ্ট রাসায়নিক দ্রবণ দ্রবীভূত করে তৈরি করা হয়। এই ক্ষেত্রে, রাউল্টস ল (একটি পদার্থবিজ্ঞানী ফ্রাঙ্কোয়া-মারি রাউল্টের নামানুসারে) নামে একটি সমীকরণ জানা দরকারী, যা এভাবে লেখা হয়েছে: পিদ্রবণ= পিদ্রাবকএক্সদ্রাবক । এই সূত্রে, ভেরিয়েবল প্রতিনিধিত্ব করে;
-
পিদ্রবণ:
সমগ্র দ্রবণটির বাষ্প চাপ (সমস্ত উপাদান একত্রিত)
-
পিদ্রাবক:
দ্রাবক বাষ্প চাপ
-
এক্সদ্রাবক:
দ্রাবকের মোল ভগ্নাংশ
- যদি আপনি মোল ভগ্নাংশের মতো পদ না জানেন তবে চিন্তা করবেন না - আমরা পরবর্তী কয়েকটি ধাপে সেগুলি ব্যাখ্যা করব।

পদক্ষেপ 2. আপনার দ্রবণে দ্রাবক এবং দ্রবণ নির্ধারণ করুন।
মিশ্র তরলের বাষ্পের চাপ গণনা করার আগে, আপনি যে পদার্থগুলি ব্যবহার করছেন তা আপনাকে অবশ্যই চিহ্নিত করতে হবে। একটি অনুস্মারক হিসাবে, একটি দ্রবণ তৈরি হয় যখন দ্রাবক দ্রবীভূত হয় - যে রাসায়নিক দ্রবীভূত হয় তাকে সর্বদা দ্রবণ বলা হয়, এবং যে রাসায়নিক এটি দ্রবীভূত করে তাকে সর্বদা দ্রাবক বলা হয়।
- আসুন এই বিভাগে সহজ উদাহরণগুলি ব্যবহার করে আমরা যে ধারণাগুলি নিয়ে আলোচনা করি তা ব্যাখ্যা করি। আমাদের উদাহরণের জন্য, ধরা যাক আমরা চিনির সিরাপের বাষ্প চাপ খুঁজে বের করতে চাই। Traতিহ্যগতভাবে, চিনির সিরাপ পানিতে দ্রবণীয় চিনি (1: 1 অনুপাত), তাই আমরা এটা বলতে পারি চিনি আমাদের দ্রাবক এবং পানি আমাদের দ্রাবক।
- উল্লেখ্য যে সুক্রোজ (টেবিল চিনি) এর রাসায়নিক সূত্র হল সি12জ22ও11। এই রাসায়নিক সূত্রটি খুবই গুরুত্বপূর্ণ হবে।
ধাপ 3. দ্রবণটির তাপমাত্রা খুঁজুন।
আমরা উপরে Clausius Clapeyron বিভাগে দেখেছি, একটি তরলের তাপমাত্রা তার বাষ্পের চাপকে প্রভাবিত করবে। সাধারণত, তাপমাত্রা যত বেশি হবে, বাষ্পের চাপ তত বেশি হবে - তাপমাত্রা যত বাড়বে তত বেশি তরল বাষ্প হয়ে বাষ্প তৈরি করবে, পাত্রে চাপ বাড়াবে।
আমাদের উদাহরণে, ধরা যাক এই সময়ে চিনির সিরাপের তাপমাত্রা কত 298 কে (প্রায় 25 গ)।
ধাপ 4. দ্রাবকের বাষ্প চাপ খুঁজুন।
রাসায়নিক রেফারেন্স উপকরণগুলিতে সাধারণত অনেকগুলি ব্যবহৃত পদার্থ এবং যৌগগুলির জন্য বাষ্পের চাপের মান থাকে, তবে এই চাপের মানগুলি কেবল তখনই বৈধ হয় যখন পদার্থটির তাপমাত্রা 25 C/298 K বা এর ফুটন্ত পয়েন্ট থাকে। যদি আপনার সমাধানের মধ্যে এই তাপমাত্রার একটি থাকে, আপনি একটি রেফারেন্স মান ব্যবহার করতে পারেন, কিন্তু যদি না হয়, তাহলে আপনাকে সেই তাপমাত্রায় বাষ্পের চাপ খুঁজে বের করতে হবে।
- Clausius -Clapeyron সাহায্য করতে পারে - P1 এবং T1 এর জন্য যথাক্রমে একটি রেফারেন্স বাষ্প চাপ এবং 298 K (25 C) ব্যবহার করুন।
- আমাদের উদাহরণে, আমাদের মিশ্রণের তাপমাত্রা 25 C, তাই আমরা সহজেই আমাদের সহজ রেফারেন্স টেবিল ব্যবহার করতে পারি। আমরা জানি যে 25 ডিগ্রি সেন্টিগ্রেডে পানির বাষ্পের চাপ থাকে 23.8 মিমি HG

ধাপ 5. আপনার দ্রাবকের তিল ভগ্নাংশ খুঁজুন।
এটি সমাধান করার আগে আমাদের শেষ কাজটি করতে হবে তা হল আমাদের দ্রাবকের মোল ভগ্নাংশ খুঁজে বের করা। মোলের ভগ্নাংশটি খুঁজে পাওয়া সহজ: কেবল আপনার যৌগগুলিকে মোলে রূপান্তর করুন, তারপরে পদার্থের মোট মোলের প্রতিটি সংখ্যার শতাংশ খুঁজুন। অন্য কথায়, প্রতিটি যৌগের তিল ভগ্নাংশ সমান (যৌগের মোল)/(পদার্থে মোলের মোট সংখ্যা)।
-
ধরুন চিনির সিরাপ ব্যবহারের জন্য আমাদের রেসিপি 1 লিটার (এল) জল এবং 1 লিটার সুক্রোজ (চিনি)।
এই ক্ষেত্রে, আমাদের অবশ্যই প্রতিটি যৌগের মোলের সংখ্যা খুঁজে বের করতে হবে। এটি করার জন্য, আমরা প্রতিটি যৌগের ভর খুঁজে পাব, তারপর পদার্থের মোলার ভর ব্যবহার করে এটিকে মোলে রূপান্তরিত করব।
- ভর (1 লিটার জল): 1,000 গ্রাম (ছ)
- ভর (কাঁচা চিনি 1 লিটার): প্রায় 1,056, 8 গ্রাম
- মোলস (জল): 1,000 গ্রাম × 1 mol/18.015 g = 55.51 mol
- মোলস (সুক্রোজ): 1,056, 7 গ্রাম × 1 মোল/342.2965 গ্রাম = 3.08 মোল (উল্লেখ্য যে আপনি সুক্রোজের মোলার ভর তার রাসায়নিক সূত্র, সি থেকে খুঁজে পেতে পারেন12জ22ও11.)
- মোট মোল: 55.51 + 3.08 = 58.59 মোল
- জলের আংশিক ভগ্নাংশ: 55, 51/58, 59 = 0, 947
ধাপ 6. শেষ।
অবশেষে, আমাদের রাউল্টের আইন সমীকরণ সমাধান করার জন্য আমাদের যা কিছু দরকার তা আছে। এই অংশটি খুব সহজ: এই বিভাগের শুরুতে সরলীকৃত রাউল্টের আইন সমীকরণের ভেরিয়েবলের জন্য কেবল আপনার মানগুলি প্লাগ করুন (পিদ্রবণ = পিদ্রাবকএক্সদ্রাবক).
- আমাদের মান প্রবেশ, আমরা পেতে:
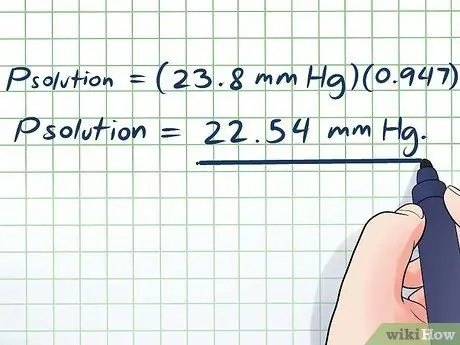
- পিসমাধান = (23.8 মিমি Hg) (0, 947)
-
পিসমাধান = 22.54 মিমি Hg
ফলাফলটি বোধগম্য হয় - তিল পদে, প্রচুর পরিমাণে চিনি দ্রবীভূত হয় (যদিও বাস্তব জগতে, উভয় উপাদানের একই পরিমাণ থাকে), তাই বাষ্পের চাপ কেবল সামান্য হ্রাস পাবে।
3 এর 3 পদ্ধতি: বিশেষ ক্ষেত্রে বাষ্পের চাপ খুঁজে বের করা

ধাপ 1. স্ট্যান্ডার্ড তাপমাত্রা এবং চাপের অবস্থার বিষয়ে সতর্ক থাকুন।
বিজ্ঞানীরা প্রায়ই ব্যবহারযোগ্য একটি "মান" হিসাবে তাপমাত্রা এবং চাপের মানগুলির একটি সেট ব্যবহার করেন। এই মানগুলিকে স্ট্যান্ডার্ড তাপমাত্রা এবং চাপ (বা এসটিপি) বলা হয়। বাষ্প চাপের সমস্যাগুলি প্রায়ই এসটিপি অবস্থার উল্লেখ করে, তাই এই মানগুলি মনে রাখা গুরুত্বপূর্ণ। এসটিপি মানগুলি সংজ্ঞায়িত করা হয়েছে:
- তাপমাত্রা: 273, 15 কে / 0 গ / 32 চ
- চাপ: 760 মিমি Hg / 1 এটিএম / 101, 325 কিলোপাস্কাল

ধাপ 2. অন্যান্য ভেরিয়েবলগুলি খুঁজে পেতে Clausius-Clapeyron সমীকরণটি পুনর্বিন্যাস করুন।
পার্ট 1 এ আমাদের উদাহরণে, আমরা দেখেছি যে খাঁটি পদার্থের জন্য বাষ্পের চাপ বের করার জন্য Clausius -Clapeyron সমীকরণ খুবই উপকারী। যাইহোক, সমস্ত প্রশ্ন আপনাকে P1 বা P2 খুঁজতে বলবে না - অনেকে আপনাকে তাপমাত্রার মান বা কখনও কখনও এমনকি H মান খুঁজতে বলবে।বাষ্প। সৌভাগ্যবশত, এই ক্ষেত্রে, সঠিক উত্তর পাওয়া কেবল সমীকরণের পুনর্বিন্যাসের বিষয় যাতে আপনি যে ভেরিয়েবলগুলি সমাধান করতে চান তা সমান চিহ্নের একপাশে আলাদা থাকে।
- উদাহরণস্বরূপ, বলুন আমাদের 273 কে তে 25 টর এবং 325 কে তে 150 টর বাষ্পের চাপ সহ একটি অজানা তরল আছে, এবং আমরা এই তরলের বাষ্পীকরণের এনথ্যালপি খুঁজে পেতে চাই (ΔHবাষ্প)। আমরা এটি এর মতো সমাধান করতে পারি:
- ln (P1/P2) = (ΔHবাষ্প/আর) ((1/টি 2) - (1/টি 1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHবাষ্প/আর)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = এইচবাষ্প এখন, আমরা আমাদের মান লিখুন:
- 8, 314 জে/(কে-মোল) × (-1, 79)/(-0, 00059) = এইচবাষ্প
- 8, 314 জে/(কে -মোল) × 3,033, 90 = এইচবাষ্প = 25,223, 83 জে/মোল

ধাপ the. দ্রবণটির বাষ্পের চাপ গণনা করুন যখন পদার্থটি বাষ্প উৎপন্ন করে।
উপরে আমাদের রাউল্ট ল উদাহরণে, আমাদের দ্রবণ, চিনি, স্বাভাবিক তাপমাত্রায় নিজের উপর কোন চাপ প্রয়োগ করে না (মনে করুন - শেষবার কখন আপনি আপনার উপরের আলমারিতে চিনির বাটি বাষ্পীভূত হতে দেখেছিলেন?) যাইহোক, যখন আপনার দ্রবণটি হয়েছিল বাষ্পীভবন, এটি আপনার বাষ্পের চাপকে প্রভাবিত করবে। রাউল্টের আইন সমীকরণের একটি পরিবর্তিত সংস্করণ ব্যবহার করে আমরা এর জন্য হিসাব করি: পিসমাধান = (পিযৌগএক্সযৌগ) প্রতীক সিগমা (Σ) এর অর্থ হল যে আমাদের উত্তর পেতে আমাদের কেবল বিভিন্ন যৌগের সমস্ত বাষ্পের চাপ যোগ করতে হবে।
- উদাহরণস্বরূপ, বলুন আমাদের দুটি রাসায়নিক দিয়ে তৈরি একটি সমাধান আছে: বেনজিন এবং টলুইন। দ্রবণের মোট আয়তন 12 মিলিলিটার (এমএল); 60 এমএল বেনজিন এবং 60 এমএল টলুইন। দ্রবণের তাপমাত্রা 25 ডিগ্রি সেলসিয়াস এবং 25 ডিগ্রি সেন্টিগ্রেডে এই প্রতিটি রাসায়নিকের বাষ্পের চাপ বেনজিনের জন্য 95.1 মিমি এইচজি এবং টলুইনের জন্য 28.4 মিমি এইচজি। এই মানগুলির সাথে, সমাধানটির বাষ্প চাপ খুঁজুন। আমরা আমাদের দুটি রাসায়নিকের জন্য স্ট্যান্ডার্ড ঘনত্ব, মোলার ভর এবং বাষ্প চাপের মান ব্যবহার করে এটি করতে পারি:
- ভর (বেনজিন): 60 mL = 0.060 L & times 876.50 kg/1,000 L = 0.053 kg = 53 গ্রাম
- ভর (টলুইন): 0.060 L এবং বার 866, 90 কেজি/1,000 L = 0.052 কেজি = 52 গ্রাম
- মোল (বেনজিন): 53 g × 1 mol/78, 11 g = 0.679 mol
- মোলস (টলুইন): 52 গ্রাম × 1 মোল/92, 14 গ্রাম = 0.564 মোল
- মোট মোল: 0.679 + 0.564 = 1.243
- মোল ভগ্নাংশ (বেনজিন): 0.679/1, 243 = 0.546
- মোল ভগ্নাংশ (টলুইন): 0.564/1, 243 = 0.454
- সমাধান: পিসমাধান = পিবেনজিনএক্সবেনজিন + পিটলুইনএক্সটলুইন
- পিসমাধান = (95.1 মিমি এইচজি) (0, 546) + (28.4 মিমি এইচজি) (0, 454)
- পিসমাধান = 51.92 মিমি Hg + 12.89 মিমি Hg = 64, 81 মিমি Hg
পরামর্শ
- উপরে Clausius Clapeyron সমীকরণ ব্যবহার করতে, তাপমাত্রা অবশ্যই কেলভিনে পরিমাপ করতে হবে (K হিসাবে লেখা)। যদি আপনার তাপমাত্রা সেলসিয়াস থাকে, তাহলে আপনাকে অবশ্যই নিম্নলিখিত সূত্র ব্যবহার করে এটি রূপান্তর করতে হবে: টিকে = 273 + টিগ
- উপরের পদ্ধতিগুলি ব্যবহার করা যেতে পারে কারণ শক্তিটি প্রয়োগ করা তাপের পরিমাণের সমানুপাতিক। তরলের তাপমাত্রা একমাত্র পরিবেশগত কারণ যা বাষ্পের চাপকে প্রভাবিত করে।






